Законы и постулаты
Открытие электрона
Периодический закон Менделеева
Опыты по рассеянию альфа-частиц
Неустойчивость атома Резерфорда
Излучение
Спектры излучения
Энергетическая диаграмма атома водорода
Энергетические переходы электронов
Объяснение происхождения линейчатых спектров
Понятие линейчатых спектров
Недостаток теории Бора
Положения квантовой механики
Принцип Паули
Закон Мозли
Вынужденное излучение
Открытие электрона
Первые экспериментальные результаты, из которых можно было сделать вывод о сложной структуре атомов электрических зарядов, были получены м. Фарадеем в 1833г. при изучении законов электролиза.
В 1897г. Дж. Дж. Томсон в результате экспериментов по изучению электрического заряда в разреженных газах, фотоэффекта и термоэлектронной эмиссии установил, что при соударениях атомов в плазме электрического заряда, при нагревании вещества или освещении его ультрафиолетовым светом из атомов любого химического элемента вырываются одинаковые отрицательно заряженные частицы. Эти частицы были названы электронами. Электрический заряд e отдельных электронов впервые был измерен в опытах Р. Милликена в 1909г. Он оказался действительно одинаковым у всех электронов.
Масса электрона примерно в 2000 раз меньше массы самого легкого из атомов – атома водорода. Открытие электрона и обнаружение электронов в составе атомов любого химического элемента было первым доказательством сложности атомов.
↑ На начало страницы
Периодический закон Менделеева
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Открытие Д. И. Менделеевым в 1869г. периодического закона поставило перед физикой вопрос о причинах повторяемости химических свойств элементов, расположенных в порядке возрастания атомной массы. Естественно было предположить, что увеличение массы атомов химических элементов связано с увеличением числа частиц, входящих в их состав. Периодическую повторяемость химических свойств элементов в таблице Менделеева можно рассматривать как свидетельство периодической повторяемости основных особенностей внутренней структуры атомов по мере увеличения числа частиц, входящих в их состав.
↑ На начало страницы
Опыты по рассеянию альфа-частиц
Большие успехи в исследовании структуры атомов были достигнуты в опытах Резерфорда по изучению рассеяния быстрых заряженных частиц при прохождении через тонкие слои вещества.
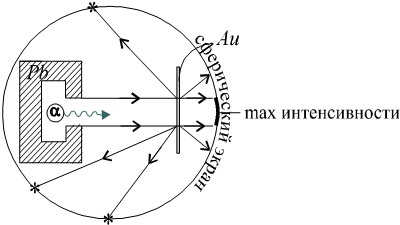 Опыт заключался в следующем: Свинцовый контейнер содержал радиоактивный элемент, излучающий α-частицы. В то время было уже известно, что α-частица имеет положительный заряд, равный удвоенному элементарному заряду, и что при потере этого заряда (при присоединении двух электронов) α-частица превращается в атом гелия. Суть опыта: Исследование распределения α-частиц после прохождения золотой плёнки (толщина плёнки 10-6÷ 10-7м).
Анализируется, сколько α-частиц попало в каждую точку сферического экрана в трёхмерном пространстве.
Опыт заключался в следующем: Свинцовый контейнер содержал радиоактивный элемент, излучающий α-частицы. В то время было уже известно, что α-частица имеет положительный заряд, равный удвоенному элементарному заряду, и что при потере этого заряда (при присоединении двух электронов) α-частица превращается в атом гелия. Суть опыта: Исследование распределения α-частиц после прохождения золотой плёнки (толщина плёнки 10-6÷ 10-7м).
Анализируется, сколько α-частиц попало в каждую точку сферического экрана в трёхмерном пространстве.
Результаты опыта:
– подавляющее количество α-частиц прошло через плёнку металла и попадало на экран непосредственно по ходу α-частиц;
– однако, в любых других точках экрана также регистрировались α-частицы вплоть до 180° отражения.
- Анализ привёл к следующему представлению модели атома:
- атом по Резерфорду очень рыхл;
- атом имеет ядро – малое по сравнению с размерами атома (Rядра≈ 10-15м, Rатома≈ 10-10м);
- в ядре сосредоточены положительные заряды;
- окружение ядра составляет электроны, так как атом в целом нейтрален;
- вся масса атома сосредоточена в ядре ( ∑ me≈ 10-4mядра).
Представленная Резерфордом модель атома была названа планетарной моделью.
Недостаток: Атомы по Резерфорду неустойчивы. Со временем, в результате Кулоновского взаимодействия электроны должны были упасть на ядро.
↑ На начало страницы
Неустойчивость атома Резерфорда (Ядерная модель атома)
Опыты по рассеянию α-частиц при прохождении их через тонкие металличаские слои показали, что некоторое количество α-частиц рассеивается на очень большие углы (почти до 180°). Основываясь на результатах этих опытов, Резерфорд предложил ядерную (планетарную) модель атома.
В центре атома находится положительно заряженное ядро с зарялом +Ze, в котором сосредоточена почти вся масса атома. Размеры ядра намного меньше размеров атома. Вокруг ядра под действием кулоновских сил движутся легкие электроны, так что 
где Ze — заряд ядра,
e — заряд электрона, взятый по модулю,
υ — скорость электрона,
m — его масса,
r — радиус орбиты,
εo — электрическая постоянная, равная 8,85*10-12Φ/м.
Как известно, любое ускореннное движение электрических зарядов сопровождается излучением электромагнитных волн. Движеие по окружности является ускоренным движением, поэтому электрон в атоме должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Это должно приводить к уменьшению энергии электрона, постепенному его приближению к атомному ядру и, наконец, падению на ядро. Таким образом, атом, состоящий из атомного ядра и обращающихся вокруг него электронов, согласно законам классической физики неустойчив. Он может существовать лишь короткое время, за которое электроны израсходуют всю свою энергию на излучение и упадут на ядро. Но в действительности атоммы устойчивы.
↑ На начало страницы
Излучение
Весь интервал известных и используемых человеком электромагнитных волн можно условно разделить на участки в соответствии со схемой.

Конечно же, границы обозначенных областей размыты.
В обиходе инфракрасное излучение называют тепловым, так как для человека оно субъективно воспринимается как тепло. Примерные пределы теплового излучения: 7*10-7÷ 10-3м. В этих пределах находится тепловое или инфракрасное или термодинамическое излучение. В связи с этим следует иметь в виду, что законы, изучаемые для любого из выбранных диапазонов, применимы для любых других типов электромагнитных волн. Наиболее наглядно изучаются законы излучения, распространения или поглощения электромагнитных волн на примере световых волн. Поэтому иногда излучение называют свечением.
Излучение несёт энергию. В обычных условиях количество энергии (тепла), излучаемого телами равно количеству тепла, поглощаемому телами из окружающей среды. То есть тепловое излучение есть равновесное излучение. Данный закон относится к небиологическим телам. У биологических объектов излучение определяется химическими процессами, происходящими с поглощаемой пищей.
Тела могут излучать электромагнитные волны под различными воздействиями.
↑ На начало страницы
Спектры излучения
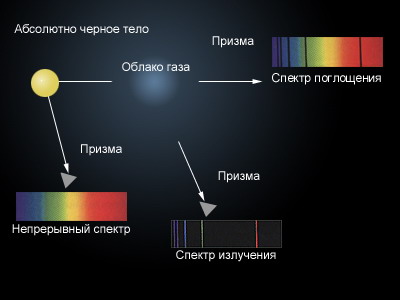
Излучение оптических спектров показало, что сложные вещества (состоящие из разных атомов) при нагреве испускают электромагнитные волны всех длин в видимом диапазоне (Например: солнце, лампы накаливания).
Однако чистые вещества, многоатомные, имеют спектры испускания, состоящие из отдельных длин волн.
Эмпирически (путём подбора чисел) было установлено, что длины волн в видимой части электромагнитных волн для водородного газа определялись λ = λ0n2 / (n2 - 4), где n - целое число, которое отсчитывается от цифры 3. Так как ν = c/λ или λ = c/ν, то подставив это в эмпирическую формулу, получим ν = ν0*(n2 - 4) / n2 = ν0*(1 - 4/n2) = 4ν0*(1/22 - 1/n2). 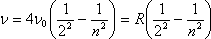
– это формула, впервые найденная Бальмером для определения частоты испускания электромагнитного излучения атомарным водородом.
Спектр излучения атомарного водорода состоит из отдельных спектральных линий, расположенных в определенном порядке. Спектральные линии образуют серии, линии которых могут быть представлены в виде обобщенной (сериальной) формулы Бальмера: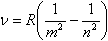
где m и n – номера состояний, R – постоянная Ридберга. При заданном m число n принимает все целочисленные значения, начиная с m+1.
- m = 1 – серия Лаймана (для ультрафиолетовой области);
- m = 2 – серия Бальмера;
- m = 3 – серия Пашена;
- m = 4 – серия Брэкета;
- m = 5 – серия Пфунда.
Если в обобщенной формуле Бальмера n>m, то спектр испускания; если m>n, то спектр поглощения.
Таким образом, эмпирически ещё до введения теорий Планка и Эйнштейна анализ спектров излучения чистых веществ, проведённый Бальмером, предвосхитил осмысление положения об электромагнитном излучении как о потоке дискретных порций энергии, не отрицая в то же время проявления волновых свойств электромагнитного излучения.
↑ На начало страницы
Энергетическая диаграмма атома водорода
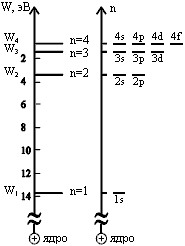 Так как расстояние электрона от ядра изменяется стремительно, а энергетическое состояние электрона на орбитах при увеличении меняется слабо, принято рисовать состояние электрона в атоме с точки зрения энергетических диаграмм (на рисунке слева).
Так как расстояние электрона от ядра изменяется стремительно, а энергетическое состояние электрона на орбитах при увеличении меняется слабо, принято рисовать состояние электрона в атоме с точки зрения энергетических диаграмм (на рисунке слева).
| Возможные состояния электрона в атоме водорода: |
| n = 1, | l = 0, | 1s |
| n = 2, | l = 0,1, | 2s,2p |
| n = 3, | l = 0,1,2, | 3s,3p,3d |
| n = 4, | l = 0,1,2,3, | 4s,4p,4d,4f |
| n = 5, | l = 0,1,2,3,4, | 5s,5p,5d,5f,5g |
Справа на рисунке изображены эти состоянияв виде энергетического спектра.
- На основании построенной диаграммы можно сделать следующие выводы:
- Если n → ∞, то энергетическое состояние такого электрона численно равно нулю. При W = 0 по условию расстояний электрон является свободным и принято наименьшее значение энергии свободного электрона, считать численно равным нулю.
- Тогда положительным значениям энергии свободного электрона присваивать энергии электрона вне атома.
- С увеличением номера орбиты интервал расстояний между соседними орбитами возрастает, а интервал значений энергии электрона между соседними орбитами уменьшается.
Таким образом, для электрона в атоме существует спектр разрешённых значений энергии. Все остальные значения энергии запрещены. Запрещённых интервалов (зон) столько же сколько орбит.
↑ На начало страницы
Энергетические переходы электронов
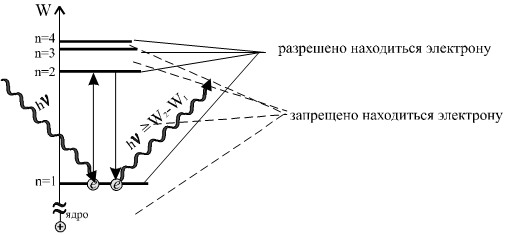 В физике существует принцип, по которому физические тела из всех возможных энергетических состояний выбирают наименьшее. Назовём его – принцип минимума собственной энергии.
В физике существует принцип, по которому физические тела из всех возможных энергетических состояний выбирают наименьшее. Назовём его – принцип минимума собственной энергии.
Тогда в соответствии с постулатами Бора: из всех возможных дискретных состояний электрон в первую очередь занимает состояние n = 1, где энергия наименьшая.
n = 1 устойчивое, стационарное состояние.
Электрон может поглотить квант только в том случае, если энергия кванта больше или равна энергетическому интервалу между состояниями электронов на орбитах. Т.е. при внешнем воздействии, если hν ≥ W2 - W1, то электрон перейдёт с 1-го на 2-ой уровень. По истечении времени без внешних воздействий электрон опять перейдёт на свободный, менее энергетический уровень. При этом он высветит квант: hν = W2 - W1.
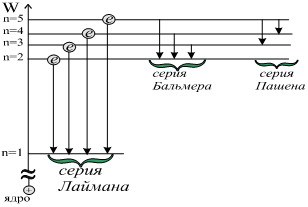 Все электронные переходы можно объединить в серии.
Все электронные переходы можно объединить в серии.
Слово серия относится к спектрам электромагнитного излучения, сопровождающим электронные переходы.
↑ На начало страницы
Объяснение происхождения линейчатых спектров
Постулаты Бора позволяют объяснить роисхождение линейчатых спектров излучения и поглощения, связывая их существование с наличием дискретного ряда энергетических состояний атомов.
Все атомы одного химического лемента обладают одинаковым зарядом атомного ядра. При одинаковом заряде ядра атомы обладают одинаковым строением электронных оболочек и потому имеют одинаковый набор возможных энергетических состояний и переходов между ними. Излучение и поглощение фотонов происходит при переходах атомов из одного разрешенного состояния в другое. Энергия фотона, поглощаемого атомом при переходе из нормального состояния с энергией E1 в возбужденное состояние с энергией En, в точности равна энергии фотона, излучаемого атомом при обратном переходе, так как и в том, и в другом случае она равна разности энергий атома в этих двух состояниях: hν = En - E1.
↑ На начало страницы
Понятие линейчатых спектров
Итак, распределение излучаемых квантов по длинам волн соответствует электронным переходам с одной фиксированной орбиты на другую. Такие спектры называют дискретными в соответствии с физикой процесса.
Это излучение можно изучать в спектроскопе, и это излучение представляется наблюдателю после прохождения основной детали – призмы в виде цветных полос. И форма этих полос определяется лишь формой диафрагмы, которая, как правило, изготавливается в виде щели, ограничивающей поток лучей. Поэтому высота линий в спектроскопе не зависит от цвета и длины волны. Высота линий, её ширина определяются конструкцией спектроскопа.
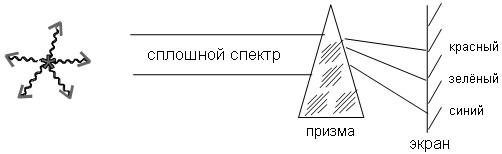 На пути сплошного потока излучения ставится диафрагма в виде щели, после неё свет попадает на разлагающую призму, в которой свет распределяется в виде полос аналогичных форме диафрагмы, положение полос на экране определяется коэффициентом преломления для соответствующей длины волны. На экране мы видим серию полос равной высоты и толщины, но разной длины волны (цвета), которые являются всего лишь отображением формы диафрагмы.
На пути сплошного потока излучения ставится диафрагма в виде щели, после неё свет попадает на разлагающую призму, в которой свет распределяется в виде полос аналогичных форме диафрагмы, положение полос на экране определяется коэффициентом преломления для соответствующей длины волны. На экране мы видим серию полос равной высоты и толщины, но разной длины волны (цвета), которые являются всего лишь отображением формы диафрагмы.
Вместо щелевой диафрагмы можно было поставить круглую диафрагму. В таком случае на экране мы бы видели серию круглых одинаковых пятен, различной длины волны или разного цвета, расположенных в тех же местах, где и для щелевой диафрагмы.
Можно было поставить квадратную диафрагму в тех же местах. Мы бы увидели систему квадратных пятен различных длин волн и т.д.
 Для человеческого глаза щелевая диафрагма наиболее удобна, так как высота позволяет отчётливо видеть линии, а малая толщина полосы позволяет разделить близко стоящие линии. Слово линейчатый – определяет особенности конструкции спектроскопа.
Для человеческого глаза щелевая диафрагма наиболее удобна, так как высота позволяет отчётливо видеть линии, а малая толщина полосы позволяет разделить близко стоящие линии. Слово линейчатый – определяет особенности конструкции спектроскопа.
У многоэлектронных атомов для каждого электрона существует своя фиксированная орбита, значение энергии и т.д. Эти электроны так же могут переходить с орбиты на орбиты, излучая или поглощая кванты. Однако, как мы убедились, не существует точной теории для расчётов спектра поглощения или спектра испускания электромагнитных волн атомами. Поскольку все электроны находятся в движении, то они взаимоискажают энергетические поля других электронов.
Но существует приближённая формула для определения частоты поглощения или испускания у многоэлектронных атомов, в которой считается, что движется только электрон, поглощающий или испускающий энергию, остальные электроны покоятся.
Эта формула называется обобщённой формулой Бальмера и выглядит следующим образом: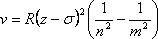
где z – номер элемента в таблице Менделеева, а σ – определяется эффектом экранирования излучающего электрона другими электронами атома.
Спектры излучения и испускания в каждом виде вещества исследуются экспериментально.
↑ На начало страницы
Недостаток теории Бора
Посчитаем для водорода длину волны при переходе электрона с 3-го энергетического уровня на 2-ой (n = 3, m = 2).
 c-1, что соответствует
c-1, что соответствует 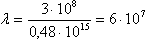 м (красный свет).
м (красный свет).
Посчитаем для ртути длину волны при n = 6, m = 5
Для многоэлектронных атомов обобщённая формула Бальмера выглядит следующим образом: 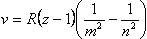
, где z – порядковый номер атома в таблице Менделеева (количество электронов в нейтральном атоме).
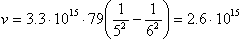 c-1;
c-1; 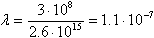 м.
м.
Получилось, что длина излучаемой волны при самом низкоэнергетическом переходе для ртути находится в ультрафиолетовой области (невидима).
Другие энергетические переходы имеют ещё меньшую длину волны, т.е. спектр излучения атома ртути не должен быть виден.
На самом же деле некоторое излучение от ртути хорошо видимо. Это и является недостатком теории Бора: необъяснимость спектров излучения большинства атомов.
↑ На начало страницы
Положения квантовой механики
- Рассмотрим основные положения квантовой механики
- Энергия испускается и поглощается телами определенными порциями – квантами. Следовательно, энергия микрочастиц изменяется скачкообразно.
- Электроны и другие микрочастицы имеют двойственную природу: с одной стороны, они проявляют свойства частиц (например, имеют массу и заряд), с другой стороны, при движении они обладают свойствами электромагнитной волны.
- Квантовая механика отрицает наличие определенных орбит у микрочастиц. Для движущихся электронов невозможно определить точное местонахождение. Они находятся в пространстве вблизи атомного ядра. Можно лишь определить вероятность нахождения электрона в различных частях пространства.
↑ На начало страницы
Принцип Паули
В одном и том же атоме (или в какой-либо другой квантовой системе) не может быть двух электронов (либо других частиц с полуцелым спином), обладающих одинаковым набором квантовых чисел.
↑ На начало страницы
Закон Мозли
 где ω – частота линий рентгеновского спектра, Z – атомный номер испускающего элемента, C и σ – константы, имеющие свое значение для каждой линии.
где ω – частота линий рентгеновского спектра, Z – атомный номер испускающего элемента, C и σ – константы, имеющие свое значение для каждой линии.
↑ На начало страницы
Вынужденное излучение
- Между энергетическими уровнями могут осуществляться следующие переходы:
- Спонтанные (самопроизволтные) переходы с более высоких на более низкие уровни. В результате наблюдуется спонтанное испускание атомами фотонов – излучение.
- Вынужденные переходы, происходящие под действием излучения с более низких на более высокие уровни. В результате наблюдается поглощение излучения веществом.
- Испускательные переходы, вызываемые действием на вещество электромагнитной волны. Такой переход сопровождается вынужденным (индуцированным) излучением вещества.
С волновой точки зрения, вынужденное излучение строго когерентно с вынуждающим излучением.
С квантовой точки зрения, процесс вынужденного излучения приводит к появлению вместо одного фотона с энергией ħω двух таких же фотонов. Новый фотон, появившийся в результате индуцированного излучения, усиливает свет
↑ На начало страницы
 Опыт заключался в следующем: Свинцовый контейнер содержал радиоактивный элемент, излучающий α-частицы. В то время было уже известно, что α-частица имеет положительный заряд, равный удвоенному элементарному заряду, и что при потере этого заряда (при присоединении двух электронов) α-частица превращается в атом гелия. Суть опыта: Исследование распределения α-частиц после прохождения золотой плёнки (толщина плёнки 10-6÷ 10-7м).
Анализируется, сколько α-частиц попало в каждую точку сферического экрана в трёхмерном пространстве.
Опыт заключался в следующем: Свинцовый контейнер содержал радиоактивный элемент, излучающий α-частицы. В то время было уже известно, что α-частица имеет положительный заряд, равный удвоенному элементарному заряду, и что при потере этого заряда (при присоединении двух электронов) α-частица превращается в атом гелия. Суть опыта: Исследование распределения α-частиц после прохождения золотой плёнки (толщина плёнки 10-6÷ 10-7м).
Анализируется, сколько α-частиц попало в каждую точку сферического экрана в трёхмерном пространстве.

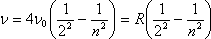
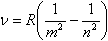
 Так как расстояние электрона от ядра изменяется стремительно, а энергетическое состояние электрона на орбитах при увеличении меняется слабо, принято рисовать состояние электрона в атоме с точки зрения энергетических диаграмм (на рисунке слева).
Так как расстояние электрона от ядра изменяется стремительно, а энергетическое состояние электрона на орбитах при увеличении меняется слабо, принято рисовать состояние электрона в атоме с точки зрения энергетических диаграмм (на рисунке слева). В физике существует принцип, по которому физические тела из всех возможных энергетических состояний выбирают наименьшее. Назовём его – принцип минимума собственной энергии.
В физике существует принцип, по которому физические тела из всех возможных энергетических состояний выбирают наименьшее. Назовём его – принцип минимума собственной энергии. Все электронные переходы можно объединить в
Все электронные переходы можно объединить в  На пути сплошного потока излучения ставится диафрагма в виде щели, после неё свет попадает на разлагающую призму, в которой свет распределяется в виде полос аналогичных форме диафрагмы, положение полос на экране определяется коэффициентом преломления для соответствующей длины волны. На экране мы видим серию полос равной высоты и толщины, но разной длины волны (цвета), которые являются всего лишь отображением формы диафрагмы.
На пути сплошного потока излучения ставится диафрагма в виде щели, после неё свет попадает на разлагающую призму, в которой свет распределяется в виде полос аналогичных форме диафрагмы, положение полос на экране определяется коэффициентом преломления для соответствующей длины волны. На экране мы видим серию полос равной высоты и толщины, но разной длины волны (цвета), которые являются всего лишь отображением формы диафрагмы. Для человеческого глаза щелевая диафрагма наиболее удобна, так как высота позволяет отчётливо видеть линии, а малая толщина полосы позволяет разделить близко стоящие линии. Слово линейчатый – определяет особенности конструкции спектроскопа.
Для человеческого глаза щелевая диафрагма наиболее удобна, так как высота позволяет отчётливо видеть линии, а малая толщина полосы позволяет разделить близко стоящие линии. Слово линейчатый – определяет особенности конструкции спектроскопа.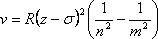
 c-1, что соответствует
c-1, что соответствует 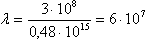 м (красный свет).
м (красный свет).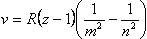
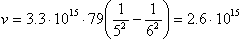 c-1;
c-1; 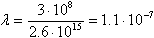 м.
м. где ω – частота линий рентгеновского спектра, Z – атомный номер испускающего элемента, C и σ – константы, имеющие свое значение для каждой линии.
где ω – частота линий рентгеновского спектра, Z – атомный номер испускающего элемента, C и σ – константы, имеющие свое значение для каждой линии.