Краткая теория
В 1903 году Томсон предложил капельную модель атома, согласно которой атом представляет собой шар, состоящий из взвешенных положительных и отрицательных частиц.
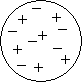 Суммарный положительный заряд шара равен сумме зарядов отрицательных электронов входящих в состав атома, так что атом в целом нейтрален. В будущем выяснилась несостоятельность этой модели атома, так что в настоящее время она имеет лишь исторический интерес как одно из звеньев в цепи развития представлений о строении атома.
Суммарный положительный заряд шара равен сумме зарядов отрицательных электронов входящих в состав атома, так что атом в целом нейтрален. В будущем выяснилась несостоятельность этой модели атома, так что в настоящее время она имеет лишь исторический интерес как одно из звеньев в цепи развития представлений о строении атома.
В 1911 году Резерфорд предложил первую ''разумную'' модель атома. Он провёл опыт, в котором экспериментально установил, как распределяются положительные и отрицательные заряды в атоме.
- Анализ опыта привёл к следующему представлению модели атома:
- атом по Резерфорду очень рыхл;
- атом имеет ядро – малое по сравнению с размерами атома (Rядра≈ 10-15м, Rатома≈ 10-10м);
- в ядре сосредоточены положительные заряды;
- окружение ядра составляет электроны, так как атом в целом нейтрален;
- вся масса атома сосредоточена в ядре ( ∑ me≈ 10-4mядра).
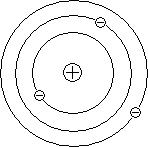 О рыхлости строения атома можно судить: если всю массу солнечной системы собрать в сплошную среду, состоящую из ядер, то получится объём, размером со спичечный коробок. Аналог такой модели имеется в нашей системе знаний – это солнечная система. Представленная Резерфордом модель атома была названа планетарной моделью.
О рыхлости строения атома можно судить: если всю массу солнечной системы собрать в сплошную среду, состоящую из ядер, то получится объём, размером со спичечный коробок. Аналог такой модели имеется в нашей системе знаний – это солнечная система. Представленная Резерфордом модель атома была названа планетарной моделью.
Недостаток: Атомы по Резерфорду неустойчивы. Со временем, в результате Кулоновского взаимодействия электроны должны были упасть на ядро.
Бор, как и Томсон до него, ищет такое расположение электронов в атоме, которое объяснило бы его физические и химические свойства. Бор берет за основу модель Резерфорда. Ему также известно, что заряд ядра и число электронов в нем, равное числу единиц заряда, определяется местом элемента в периодической системе элементов Менделеева. Таким образом, это важный шаг в понимании физико-химических свойств элемента.
“Основным результатом тщательного анализа видимой серии линейчатых спектров и их взаимоотношений, - писал Бор, - было установление того факта, что частота uкаждой линии спектра данного элемента может быть представлена с необыкновенной точностью формулой ν = T' - T", где T' и T" – какие-то два члена из множества спектральных элементов Т, характеризующих элемент”.
Бору удалось найти объяснение этого основного закона спектроскопии. Но для этого ему пришлось ввести в физику атома представления о стационарных состояниях атомов, находясь в которых электрон не излучает, хотя и совершает периодическое движение по круговой орбите. Свои представления об особых свойствах атомов (устойчивости атома и спектральных закономерностей его излучения) Бор сформулировал в виде постулатов.
К 1917 г. идеи Бора получили всестороннее развитие как в работах самого Бора, так и других авторов. Они были экспериментально подтверждены, и теория Бора получила всеобщее признание.
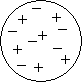 Суммарный положительный заряд шара равен сумме зарядов отрицательных электронов входящих в состав атома, так что атом в целом нейтрален. В будущем выяснилась несостоятельность этой модели атома, так что в настоящее время она имеет лишь исторический интерес как одно из звеньев в цепи развития представлений о строении атома.
Суммарный положительный заряд шара равен сумме зарядов отрицательных электронов входящих в состав атома, так что атом в целом нейтрален. В будущем выяснилась несостоятельность этой модели атома, так что в настоящее время она имеет лишь исторический интерес как одно из звеньев в цепи развития представлений о строении атома.
 О рыхлости строения атома можно судить: если всю массу солнечной системы собрать в сплошную среду, состоящую из ядер, то получится объём, размером со спичечный коробок. Аналог такой модели имеется в нашей системе знаний – это солнечная система. Представленная Резерфордом модель атома была названа
О рыхлости строения атома можно судить: если всю массу солнечной системы собрать в сплошную среду, состоящую из ядер, то получится объём, размером со спичечный коробок. Аналог такой модели имеется в нашей системе знаний – это солнечная система. Представленная Резерфордом модель атома была названа